El Previo del Mes (PDM) del 2012 [1] discutió el comportamiento de la fase de hidratos de los gases naturales agrios. Específicamente, se mostró que la presencia del Dióxido de Carbono inhibe la formación de éstos en forma leve, mientras que el Sulfuro de Hidrógeno aúpa la formación de los hidratos en forma considerable. Este previo extenderá el citado previo estudio sobre la formación de los hidratos en los gases naturales. Específicamente, estudiaremos el impacto del nitrógeno sobre la formación de los hidratos en una mezcla del gas natural.
La temperatura de formación de hidratos en un gas depende de la presión de composición del sistema. Existen varios métodos para el cómputo de las condiciones de formación de los hidratos [2-5]. Las referencias [2-3] presentan métodos rigorosos, mientras que los [4-5] revelan aquellos que logran cómputos resumidos, que simplifican los que efectúan manualmente. Este estudio aplica un método rigoroso aplicando la ecuación de estado Soave-Redlich-Kwong (SRK) [6] en el conjunto de programas de computación “software” de ProMax [7].
La Tabla 1 presenta las composiciones de los gases en el estudio. Nótese que en cada caso un promedio de 20 % del metano fue remplazado con la misma concentración de nitrógeno, dióxido de carbono, o sulfuro de hidrógeno (sulfhídrico).
Tabla 1. Composiciones de las mezclas de gas saturado con agua del estudio
La Figura 1 presenta la curva de formación de hidratos (curva intermitente), más la porción del punto de rocío de la envolvente del gas natural dulce (curva continua). La Figura 1 también presenta las curvas del punto de rocío y formación de hidratos del gas conteniendo 20 % molar de Nitrógeno (N2).
La Figura 1 indica que la presencia de un 20 % molar de N2, desplaza la curva de formación de hidratos levemente hacia la izquierda, así reduciendo la temperatura de formación de éstos. Nótese que los puntos la izquierda y por encima de las curvas de hidratación representan la región de formación de los hidratos. Desde un punto de vista operacional, esta región debe ser evitada. Esta figura igual indica que la presencia del N2 aumenta la cricondenbara, y la región bi-fásica (gas + líquido) de la envolvente se expande.
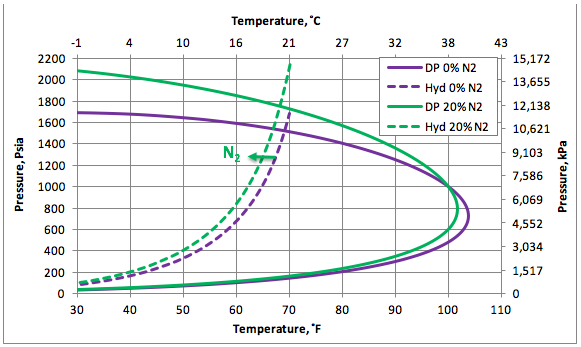
Figura 1. El impacto del N2 sobre las curvas de punto de rocío y formación de hidratos.
La Figura 2 presenta los resultados calculados de las curvas de formación de hidratos para un gas dulce (curva continua) sin el N2, los gases agrios conteniendo un 20 % molar de CO2, o H2S, y un gas dulce conteniendo un 20 % molar del N2 (curvas intermitentes). Esta figura indica claramente que le impacto de N2 es sustancialmente menor que el de H2S, y levemente menor que el de CO2. El Nitrógeno y el Dióxido de Carbono deprimen las condiciones de formación de hidratos (desplazan las curvas de éstas hacia la izquierda) pero el H2S aúpa la formación de hidratos considerablemente. Como ejemplo, a 1000 lpca (6900 kPa), el N2 reduce la formación de los hidratos de este gas dulce en unos 4.5˚F (2.5˚C), mientas que el CO2 reduce ésta formación en unos 5.5˚F (3˚C), y el H2S aumenta la misma en unos 20˚F (11.1˚C).
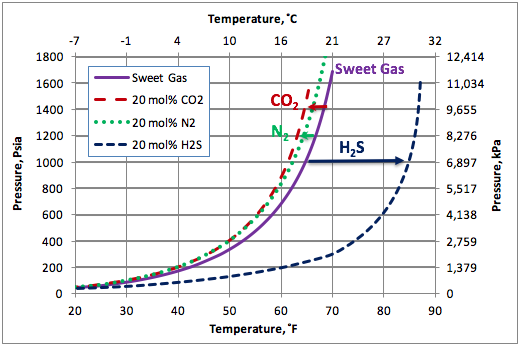
Figura 2. Impacto de los no-hidrocarburos sobre la curva de formación de hidratos.
Conclusiones:
Katz y colaboradores [8] desarrollaron un juego de constantes de equilibrio (Kv-s) aplicables para las predicciones de los hidratos. En éste método Katz, descrito en la página 161 del Capítulo 6 referencia [6] “el nitrógeno es un formador de hidratos, y es probable que una presencia de éste gas puede presentarse en las estructuras reticulares de los hidratos relacionados con un sistema típico del gas natural. Sin embargo, no es factor en la determinación de las condiciones de formación de los hidratos al menos que se presentan mezclas de nitrógeno y metano que a veces se observan en la producción del metano de origen de lechos carboníferos. En estos casos la estructura del conjunto N2 – CH4 presentará menor temperatura de formación de hidratos que el metano puro. De manera práctica, la aplicación del Kv-s = (infinito) para el nitrógeno arroja resultados satisfactorios para una mezcla de gases típicos”.
Este estudio ha mostrado que la presencia del N2, CO2 y H2S en un gas natural arroja un impacto adverso sobre las condiciones de formación de los hidratos. Mientras que el impacto del N2 y el CO2 es mínimo pero con resultados en la misma dirección, el H2S imparte resultados en dirección opuesta. Para las mismas composiciones y condiciones en estudio, el nitrógeno y dióxido de carbono deprimen levemente la temperatura de formación (imparte propiedades de inhibición, y desplaza la curva de hidratación hacia la izquierda) mientras que el H2S desplaza ésta a la derecha considerablemente, promoviendo las condiciones de formación de los hidratos, y pueden ser causa de serios problemas operacionales.
Para informarse adicionalmente sobre casos similares, y como minimizer sus problemas operacionales, les sugerimos su asistencia a nuestras sesiones técnicas G4 (Gas Conditioning and Processing), G5 (Advanced Applications in Gas Processing), P81 (CO2 Surface Facilities), y PF4 (Oil Production and Processing Facilities),
PetroSkills ofrece su experiencia de consultoría en este tema y muchos adicionales. Para mayor información sobre estos servicios, les invitamos nos visiten en nuestra dirección en la red al http://petroskills.com/consulting, o nos envían correo electrónico al consulting@PetroSkills.com.
Por: Dr. Mahmood Moshfeghian
Traducido al Español por: Dr. Frank E. Ashford
Reference:
- Moshfeghian, M. http://www.jmcampbell.com/tip-of-the-month/2012/12/sour-gas-hydrate-formation-phase-behavior/
- Parrish, W.R., and J.M. Prausnitz, “Dissociation pressures of gas hydrates formed by gas mixtures,” Ind. Eng. Chem. Proc. Dev. 11: 26, 1972.
- Holder, G. D., Gorbin, G. and Papadopoulo, K.D, “Thermodynamic and molecular properties of gas hydrates from mixtures containing methane. argon, and krypton,” Ind. Eng. Chem. Fund. 19(3): 282, 1980.
- Campbell, J.M., Gas Conditioning and Processing, Volume 1: The Basic Principles, 9th Edition, 2nd Printing, Editors Hubbard, R. and Snow–McGregor, K., Campbell Petroleum Series, Norman, Oklahoma, 2014.
- Gas Processors Suppliers Association; “ENGINEERING DATA BOOK” 13th Edition – FPS; Tulsa, Oklahoma, USA, 2012.
- Soave, Chem. Eng. Sci. 27, 1197-1203, 1972.
- ProMax 3.2, Bryan Research and Engineering, Inc, Bryan, Texas, 2015.
- Carson, D. B. and D. L. Katz, Trans. AIME, Vol. 146, p. 150, 1942.

No comments yet. You should be kind and add one!
By submitting a comment you grant Campbell Tip of the Month – Spanish a perpetual license to reproduce your words and name/web site in attribution. Inappropriate and irrelevant comments will be removed at an admin’s discretion. Your email is used for verification purposes only, it will never be shared.